Kutatásvezető neve
Dr. Tamás A. Martinek
Medical Chemistry, University of Szeged, Faculty of Medicine

Támogatás összege
25 085 538 Ft
A kutatás rövid ismertetője
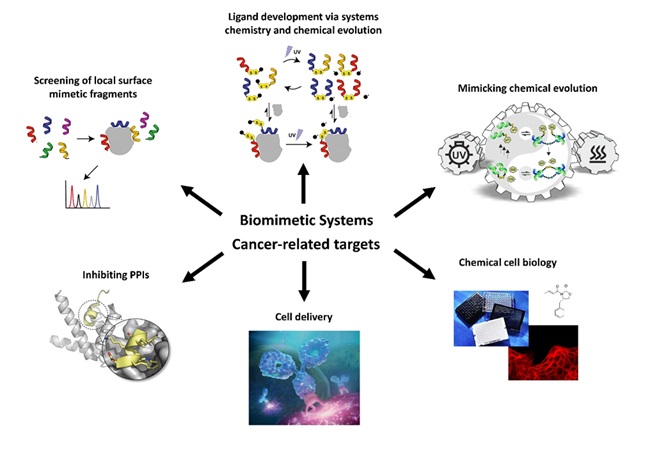
Rákellenes molekulák fejlesztéséhez a kémiai biológia és a rendszerkémia frontvonalában lévő kihívásokat célozzuk meg.
Fehérje-fehérje kölcsönhatások. A fehérje-fehérje kölcsönhatások számos rákos sejtfolyamatban játszanak szerepet, melyek befolyásolása terápiás szempontból előnyös lehet. Olyan módszertani fejlesztéseken dolgozunk, amelyek segítségével új típusú biomimetikus hatóanyagok hozhatók létre, amelyek befolyásolni képesek a rák progressziójával összefüggésbe hozható, nehezen támadható fehérje-fehérje kölcsönhatásokat. Egyik megközelítésünk a racionális tervezés, mely során előzetes szerkezeti információk alapján fejlesztjük tovább az inhibitorokat, például egy ismert peptid ligandumot kémiailag módosítunk, hogy javítsuk annak tulajdonságait. Fragmens alapú megközelítésünk során kisméretű, a fehérje felszínt utánzó béta-peptid foldamereket használunk építőelemként, melyek megfelelő összekapcsolásával erősebb kötődés érhető el, így a fehérje-fehérje kölcsönhatások befolyásolására alkalmas biomimetikus molekulák tervezhetők.
Letöltések

Biomimetikumok fejlesztése rendszerkémia és kémiai evolúció segítségével. A biomimetikus anyagok fragmens alapú tervezése során a legjobb multivalens ligandumok kiválasztásához rendszerkémiai megközelítéseket alkalmazunk. A termodinamikai szabályzás alatt álló fehérje-templátolt dinamikus kombinatorikus könyvtárakban a molekuláris felismerés továbbítja a szerkezeti információkat a ligandumok felé, így elősegíti a nagy affinitású multivalens ligandumok képződését. A kémiai evolúción alapuló molekuláris rendszerek az egyensúlytól távol működnek, és külső energiabevitelt igényelnek az entrópiatermelés fedezéséhez. Létrehoztunk egy kémiai evolúciót utánzó, UV fénnyel működő kémiai hálózatot primitív biomimetikus peptid foldamer komponensekkel, amelyek szekvenciafüggő replikációt és replikátor lebontást mutatnak. Ezt a rendszert a célfehérjét szelekciós faktorként (templátként) használva ligandum fejlesztésre adaptáljuk.
Sejtpenetráció. Az emlős sejtek membránja többnyire áthatolhatatlan az extracelluláris fehérjék számára, amelyek potenciálisan specifikus és tolerálható gyógyszerekként működhetnek. Ezért nagy szükség van olyan módszerekre, amelyekkel fehérjéket juttathatunk az intracelluláris célpontokhoz. Létrehoztunk egy pentapeptid jelölőn alapuló konstruktot, amely képes terápiásan releváns koncentrációk (nM) mellett a lipid raft által közvetített endocita útvonalra irányítani és így a sejtbe juttatni a makromolekulákat.
Kémiai sejtbiológia. A kémia és a biológia határán mozogva a rákos sejtek növekedésével, migrációjával és metasztázisával kapcsolatos kérdésekre a hagyományos biológiai megközelítéseket kiegészítve keresünk választ. A Raf kináz inhibitor fehérje (RKIP) szerepére összpontosítunk, amely az intracelluláris jelátvitel multifunkcionális modulátora.
Válogatott közlemények:
Light-fuelled primitive replication and selection in evolvable biomimetic chemical networks. Bartus, É.; Tököli, A.; Mag, B.; Bajcsi, Á.; Kecskeméti, G.; Wéber, E.; Kele, Z.; Fenteany, G.; Martinek, T. A. J. Am. Chem. Soc. 2023, 145, 13371-13383.
Promiscuity Mapping of the S100 Protein Family Using a High-Throughput Holdup Assay. Simon, M. A.; Bartus, É.; Mag, B.; Boros, E.; Roszjár, L.; Gógl, G.; Travé, G.; Martinek, T. A.; Nyitray, L. Sci. Rep. 2022, 12 (1), 5904.
Proteomimetic Surface Fragments Distinguish Targets by Function. Tököli, A.; Mag, B.; Bartus, É.; Wéber, E.; Szakonyi, G.; Simon, M. A.; Czibula, Á.; Monostori, É.; Nyitray, L.; Martinek, T. A. Chem. Sci. 2020, 11 (38), 10390–10398.
Routing Nanomolar Protein Cargoes to Lipid Raft-Mediated/Caveolar Endocytosis through a Ganglioside GM1-Specific Recognition Tag.Imre, N.; Hetényi, A.; Szabó, E.; Bodnár, B.; Szkalisity, A.; Gróf, I.; Bocsik, A.; Deli, M. A.; Horvath, P.; Czibula, Á.; Monostori, É.; Martinek, T. A. Adv. Sci. 2020, 7 (4).
Structural Optimization of Foldamer-Dendrimer Conjugates as Multivalent Agents against the Toxic Effects of Amyloid Beta Oligomers. Bartus, É.; Olajos, G.; Schuster, I.; Bozsó, Z.; Deli, M. A.; Veszelka, S.; Walter, F. R.; Datki, Z.; Szakonyi, Z.; Martinek, T. A.; Fülöp, L. Molecules 2018, 23 (10)
De Novo Modular Development of a Foldameric Protein–Protein Interaction Inhibitor for Separate Hot Spots: A Dynamic Covalent Assembly Approach. Bartus, É.; Hegedüs, Z.; Wéber, E.; Csipak, B.; Szakonyi, G.; Martinek, T. A. ChemistryOpen 2017, 6 (2), 236–241.